Introducción
El equipo médico duradero es fundamental para el apoyo al diagnóstico y tratamiento de los pacientes, por lo que debe ser seguro, eficaz y confiable. También representa una gran inversión de capital y, por lo tanto, debe contar con un soporte para maximizar su vida útil.
El desafío para aquellos responsables del mantenimiento de este equipo radica tanto en el espectro como en la cantidad de dispositivos, según el tamaño y la especialización de su institución.
En los primeros días del mantenimiento del equipo médico, no existían estándares ni convenciones para la verificación de la seguridad y el funcionamiento del equipo. El personal de Ingeniería Clínica (o sus predecesores) dependía de los procedimientos o recomendaciones de los fabricantes. Sin siquiera un diagrama esquemático o un diagrama de bloques, todo lo que quedaba era la intuición técnica. El apoyo del fabricante en este sentido variaba desde completo hasta inexistente, y la tendencia actual es hacia menos información por parte de los fabricantes.
El mantenimiento programado anteriormente se basaba principalmente en el temor a las responsabilidades por lesiones a los pacientes. El departamento biomédico típico cumplía con convenciones informales de la industria principalmente mediante la documentación de la finalización de los procedimientos de mantenimiento preventivo (PM), con poca o ninguna documentación de controles de seguridad o tasas de falla que justificaran la profundidad y frecuencia de esos PM.
Después de que se prestó atención muy pública, aunque distorsionada, a la seguridad eléctrica del equipo médico a principios de la década de 1970, organizaciones establecedoras de estándares como AAMI y ECRI establecieron estándares de seguridad eléctrica, y la Comisión Conjunta comenzó a enfocarse más en el mantenimiento del equipo médico. ECRI utilizó por primera vez el término “inspección de mantenimiento preventivo” en 1972, que incluía más que la verificación de la seguridad eléctrica y un examen superficial. A mediados y finales de la década de 1980, se ofrecieron varios modelos diferentes como un medio para asignar dispositivos médicos a diferentes frecuencias de inspección según el nivel de riesgo, la función (terapéutica, diagnóstica o de monitoreo) y la intensidad del mantenimiento. Para 1996, la Sociedad Estadounidense de Ingeniería de Atención Médica propuso un método para clasificar el nivel de riesgo de cualquier dispositivo clínico, utilizando una fórmula de cinco factores: función, aplicación clínica, requisito de mantenimiento preventivo, probabilidad de falla y entorno de uso. La “probabilidad de falla” dependía de determinar el tiempo promedio entre fallas (MTBF, por sus siglas en inglés). En 2006, se ofreció una mejora en los modelos anteriores que aborda las debilidades de los sistemas anteriores al considerar la rentabilidad y, lo más importante, una revisión continua de los resultados.
Convenciones y prácticas actuales
La gestión del equipo médico debe:
- Verificar la disponibilidad de cada dispositivo,
- Asegurarse de que cada dispositivo cumpla con sus especificaciones funcionales,
- Asegurarse de que cada dispositivo sea seguro tanto para el paciente como para el usuario,
- Abordar el eventual reemplazo del dispositivo.
A nivel internacional, existen una amplia variedad de procesos de inspección o acreditación para hospitales. Algunos países tienen poca o ninguna evaluación periódica de sus hospitales, mientras que en otros países están regulados por una agencia gubernamental. La mayoría de ellos son inspeccionados por una agencia de acreditación colaborativa relativamente independiente. Hay muchas de estas agencias y hay una tendencia a armonizar sus estándares. Muchas de ellas se enumeran en las referencias a continuación. Dos de las organizaciones más globales son la Organización Mundial de la Salud (OMS) y la Comisión Conjunta Internacional (JCI). La OMS ha fomentado la acreditación estandarizada desde hace algunos años, y la JCI es parte de ese esfuerzo. En sus “Estándares de Acreditación para Hospitales” de 2011, la JCI aborda el mantenimiento de equipos médicos dentro de su sección sobre “Gestión y Seguridad de las Instalaciones”, los ítems FMS.8.1 y FMS.8.2. Ítems casi idénticos también se encuentran en los requisitos de otras agencias de acreditación, por ejemplo, la Junta Nacional de Acreditación de Hospitales de la India (NABH) especifica cuatro actividades bajo el título “La organización tiene un programa para la gestión de equipos de apoyo clínico y de servicio” en su sección FMS.3. La Federación Europea de Hospitales y Atención Médica trata el equipo clínico en su libro de referencia anual “Hospital Healthcare Europe”.
En los Estados Unidos, la gran mayoría de los centros de atención médica se suscriben a la acreditación de The Joint Commission (TJC) (anteriormente JCAHO). La gestión de dispositivos médicos se aborda en su manual de estándares en la sección de Entorno de Atención (EC). Esta sección se subdivide en estándares, y cada estándar incluye una serie de “elementos de desempeño” (EP) que especifican requisitos. Los relevantes para este documento son:
- EC.02.02.01 EP 2: requiere que Ingeniería Clínica mantenga un inventario actualizado de todos los dispositivos.
- EC.02.02.01 EP 3: requiere que exista un sistema de mantenimiento que garantice el funcionamiento confiable del equipo.
- EC.02.02.01 EP 4: requiere un plan documentado para los intervalos de mantenimiento.
- EC.02.02.01 EP 6: requiere procedimientos por escrito para gestionar las fallas del equipo.
- EC.02.04.03 EP 1: requiere que todo el equipo sea verificado en cuanto a seguridad y funcionalidad antes de su uso inicial.
- EC.02.04.03 EP 2: requiere que el equipo de soporte vital se mantenga, dentro del cronograma, al 100 %.
- EC.02.04.03 EP 3: requiere mantenimiento para todo el equipo que no sea de soporte vital, de acuerdo con las pautas del departamento.
- EC.04.01.01 EP 15: requiere una evaluación anual del plan de gestión de equipos, con revisiones. En cualquier entorno a nivel mundial, el gerente del departamento responsable del equipo clínico debe conocer los estándares por los cuales su empleador es evaluado y organizar un plan de mantenimiento que cumpla y supere esos estándares.
Si bien existe un estándar establecido para la seguridad eléctrica en dispositivos de atención al paciente, no hay estándares para los protocolos de mantenimiento. Sin embargo, existen convenciones y recomendaciones específicas para tipos de dispositivos. El mantenimiento en el sentido más amplio es tanto proactivo (es decir, verificaciones de seguridad y funcionalidad, reemplazo de componentes propensos a fallas y correcciones impulsadas por el fabricante) como reactivo (es decir, reparación de fallas).
“El mantenimiento preventivo” puede ser algo engañoso. ¿Qué estamos previniendo? Si encontramos una unidad segura y funcional hoy, ¿qué garantías hay de que no fallará mañana? Ninguna, pero conocemos la probabilidad de falla en función del historial del dispositivo, y la tendencia actual es hacia programas “basados en evidencia” o “centrados en la confiabilidad”. Un mejor término para “PM” podría ser “Protocolo de Gestión”, y debería incluir el reemplazo proactivo de componentes propensos a fallas, verificación de la funcionalidad según las especificaciones del fabricante y verificación de la seguridad eléctrica.
El término “inspección” a menudo se intercambia con “mantenimiento”, lo que crea cierta ambigüedad al hablar de la gestión del equipo. “Inspección” se utiliza mejor para referirse a la evaluación más básica de un dispositivo en términos de seguridad y competencia aparente, como cuando se evalúa un dispositivo en préstamo o un demostrador.
Al final del día, es importante recordar que el paciente, el verdadero cliente y usuario final que en última instancia paga por la tecnología y nuestros salarios, confía en que su atención clínica incluirá equipos que sean seguros, completamente funcionales y gestionados de manera rentable.
Preparación general para los protocolos de gestión
Suponiendo que su departamento o empresa utilice un sistema informatizado de gestión de mantenimiento (CMMS), tendrá un grupo específico de dispositivos para revisar cada mes. Una táctica común es dividir y conquistar: identificar grupos de dispositivos similares o idénticos y determinar cuándo y dónde se puede acceder a ellos. Esto implica inevitablemente una interacción diplomática con el personal clínico usuario, y uno de los inconvenientes del mantenimiento de equipos médicos es simplemente acceder a los dispositivos. Dependiendo del número de dispositivos y su ubicación, establezca un horario flexible para el mantenimiento.
Para la mayoría del equipo, el mantenimiento puede (o debe) hacerse en el lugar, es decir, en las ubicaciones de los usuarios. Esto pone énfasis en una buena planificación: piense con anticipación en el equipo que se va a mantener y reúna los analizadores de rendimiento adecuados, simuladores, analizadores de seguridad eléctrica, aparatos de prueba específicos del modelo y cualquier consumible específico que pueda ser necesario. Esto se suma a los elementos básicos para el trabajo biomédico: un conjunto de herramientas adecuado, etiquetas de mantenimiento preventivo, un agente de limpieza desinfectante, lubricantes, gas enlatado para limpiar el polvo, removedor de adhesivo, trapos y una pequeña aspiradora. Tenga su lista de dispositivos a revisar, ya sea en formato impreso, en una computadora portátil o en un dispositivo portátil. Y por último, tenga disponible el protocolo de mantenimiento recomendado por el fabricante en formato impreso, si aún no está incorporado en su aplicación de CMMS. La mayoría de los técnicos reúnen todo esto en un carrito de utilidad compacto.
Protocolo recomendado: electrocardiógrafos para adultos/infantes Los potenciales eléctricos generados por el corazón se han utilizado con fines diagnósticos durante más de un siglo, y el electrocardiógrafo (ECG) sigue siendo uno de los primeros parámetros utilizados por los médicos para evaluar al paciente. Ha habido variantes, pero la nomenclatura, ubicación y codificación por colores de los electrodos del ECG están estandarizadas. La prueba del canal de ECG en un monitor debe incluir una variedad de formas de onda normales, con y sin artefactos añadidos. También se puede someter a prueba la unidad en prueba (UUT, por sus siglas en inglés) con varias formas de onda no clínicas destinadas a verificar la respuesta en frecuencia de la unidad, la ganancia, la capacidad para detectar elementos específicos del ECG típico y el rendimiento de la impresora de ECG. 3 Pruebas de monitores médicos multifunción de Fluke Biomedical Un simulador de función completa también ofrecerá una variedad de arritmias útiles para el entrenamiento y la verificación del rendimiento.
Utilizando el cable de ECG suministrado normalmente, la UUT debe conectarse al simulador prestando atención a la correspondencia de los colores (los conectores de ECG en el simulador deben cumplir con los estándares AAMI e IEC). Idealmente, el cable debería incluir los diez conectores para verificar completamente los doce derivaciones estándar del ECG, incluyendo V1 a V6, por separado. Como mínimo, el cable debe tener cinco conectores, incluyendo uno para una derivación de pecho. Cuando se encienda, la mayoría de los simuladores proporcionarán un ECG preconfigurado con un ritmo sinusal normal (NSR), a una frecuencia cardíaca de reposo y amplitud normales, sin artefactos ni desviaciones de un ECG ideal.
La mayoría de los simuladores proporcionarán una selección de preconfiguraciones que varían del ECG normal, lo que permite al técnico probar la UUT en una variedad de extremos de frecuencia cardíaca, amplitud, desviaciones del segmento S-T y artefactos. Verificar que la UUT responda dentro de las especificaciones a estas variantes brindará tranquilidad de que cumple con las expectativas. Si la UUT lo justifica, el técnico también puede modificar cualquiera de las variables a extremos mayores. Probar la respuesta a frecuencias cardíacas muy altas y muy bajas, por ejemplo, puede revelar un deterioro en las funciones de la UUT. Aplicar una onda de rendimiento “Tall-T Reject” puede verificar que la UUT responderá como se espera a pacientes con anomalías cardíacas. Agregar artefactos de 50 Hz o 60 Hz al ECG confirmará la efectividad del filtro para esas frecuencias de línea eléctrica.
Según el modelo que se esté probando, las políticas de su empleador y las limitaciones de tiempo, el técnico deberá formular una lista de las pruebas del canal de ECG que sean apropiadas y aplicarlas de manera consistente a todas las unidades.

Protocolo recomendado: Monitores fetales/maternos
Los monitores electrónicos fetales detectan, muestran y registran tres parámetros específicos del paciente en trabajo de parto: la frecuencia cardíaca fetal (FHR, por sus siglas en inglés), la presión intrauterina y la fuerza de contracción uterina. La frecuencia cardíaca fetal se simula como un electrodo fetal en el cuero cabelludo, mediante la conexión al adaptador de electrodo del cuero cabelludo desde la UUT. Se conectan cables puente desde los postes de ECG del simulador al adaptador provisto para la UUT. Los simuladores capaces de probar monitores fetales permitirán al técnico variar la frecuencia cardíaca fetal desde valores anormalmente bajos, como 60 latidos por minuto, hasta 240 latidos por minuto, con un valor predeterminado típico de 140.
En el entorno de trabajo de parto, la presión intrauterina se detecta mediante la colocación de un catéter en el útero. Esto se puede simular utilizando el mismo canal de presión utilizado para la simulación de la presión arterial, a través de un cable adaptador hacia la UUT. Las contracciones simuladas se representan mediante una curva de presión en forma de campana, que alcanza un pico de 90 mmHg y se puede repetir en intervalos clínicamente típicos, como 2, 3 o 5 minutos. Con cada aumento de la presión de la contracción, la frecuencia cardíaca fetal simulada disminuye para imitar una respuesta fetal normal a cada contracción. El simulador también se puede configurar para respuestas anormales de la frecuencia cardíaca fetal con cada contracción: desaceleración temprana (la FHR disminuye antes de lo normal), desaceleración tardía (la respuesta de la FHR se retrasa) o una aceleración uniforme en la que la FHR se acelera en lugar de disminuir.
Además de ser una herramienta de entrenamiento valiosa, los simuladores con esta función pueden probar un monitor fetal y su grabadora a través de todo su rango de valores clínicos.

Protocolo recomendado: Presión arterial no invasiva
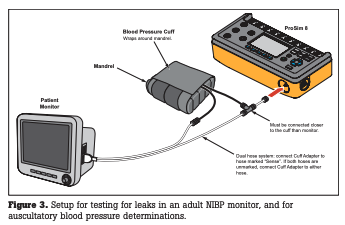
La técnica oscilométrica para determinar la presión arterial es una variante del método no invasivo (auscultatorio) original creado por Riva-Rocci. Un manguito que rodea una extremidad que incluye una arteria principal se presuriza hasta un punto por encima de la presión arterial sistólica presumida. La presión del manguito se comunica con un transductor en el monitor. A medida que la presión del manguito disminuye lentamente (normalmente a 6 u 8 mm Hg por segundo), se alcanzará el punto en el que iguala los pulsos de presión arterial sistólica, lo que hace que la arteria se “abre” brevemente. Esto provoca una pulsación en la neumática del manguito que es detectada por el transductor y registrada electrónicamente como la presión sistólica. A medida que la presión en el manguito disminuye aún más, alcanza un punto en el que la amplitud de las pulsaciones arteriales alcanza su máximo; este punto se registra electrónicamente como la presión arterial media. Finalmente, cuando la presión en el manguito disminuye hasta el punto en que no se detectan más pulsaciones arteriales, la electrónica lo registra como el punto diastólico. Las tres presiones, sistólica, media y diastólica, se muestran en el monitor, junto con la frecuencia cardíaca derivada de las pulsaciones. La forma específica en que se controla la neumática y la interpretación de la curva de presión a lo largo del tiempo son cuestiones de software propietario de diferentes fabricantes. Un simulador puede mostrar un valor ligeramente diferente para la presión arterial no invasiva (NIBP, por sus siglas en inglés) en una variedad de monitores, pero el rango de precisión del simulador debe ser mucho más “ajustado” que el especificado para el monitor.
El primer problema a verificar en un monitor de NIBP es su integridad neumática: los valores de NIBP no tienen sentido si hay una fuga en el sistema. Se configura un manguito o un depósito entre la UUT y el simulador, y luego se establece la UUT para cerrar su válvula de ventilación colocándola en su modo “Servicio” o “Calibración”. Ahora se le pide al simulador que presurice el sistema hasta una presión objetivo seleccionada por el usuario (sugerimos al menos 300 mmHg) y un gráfico en pantalla indicará la presión en tiempo real. Si el gráfico muestra que la presión disminuye, habrá una fuga evidente.
Para probar de manera realista el canal de NIBP, el simulador debe inflar un manguito de presión arterial como parte de la neumática del conjunto de pruebas. Si eso no es posible, se podría usar una cámara cuyo volumen se acerque al de un manguito. De cualquier manera, el conjunto de pruebas debe incluir un depósito que emule la neumática de un escenario típico de NIBP. La mayoría de los simuladores incluyen un conjunto de mandriles de plástico que pueden simular una variedad de circunferencias del brazo. En su lugar, varios tramos de tubería de PVC de diferentes diámetros (3 cm a 13 cm) serán suficientes. Una vez que la UUT y el simulador estén dispuestos, se puede iniciar el ciclo de NIBP del simulador. Cualquier simulador tendrá combinaciones preestablecidas que emulan situaciones normales y anormales, por ejemplo, 120/80 (93), 60/30 (40), 200/150 (167), etc. Para pacientes neonatales, los ajustes preestablecidos cubren un rango más bajo de valores desde una presión sistólica de 35 hasta 150 mmHg. Se debe evaluar la UUT en los extremos de estos ajustes preestablecidos para verificar que esté dentro de las especificaciones del fabricante. También se deben ejecutar varios ciclos del mismo ajuste preestablecido para confirmar la repetibilidad de la UUT. Un simulador de función completa también proporcionará la opción de variar el volumen del pulso. Puede ser muy útil desafiar a un monitor con volúmenes de pulso inferiores a los típicos (por ejemplo, 0.2 o 0.3 ml) para simular a un paciente con un bajo gasto cardíaco u otra enfermedad.
Finalmente, es una cuestión de seguridad del paciente verificar que la UUT no pueda permitir una presión excesivamente alta en la neumática, como en un escenario de una válvula de alivio bloqueada que hace que la bomba continúe presurizando el sistema. Aquí también, la UUT debe estar en su modo “Servicio” o “Calibración”. Se configura el simulador a una presión objetivo (digamos 350 mmHg) y se le pide que inicie una prueba. Si y cuando la válvula de alivio en la UUT se abre, el simulador dejará de bombear y mostrará un mensaje que indica que la prueba ha pasado. El usuario deberá consultar las especificaciones de la UUT para conocer el punto de activación de la válvula de alivio.
La mayoría de los simuladores también pueden servir como referencia para verificar el indicador de un esfigmomanómetro o el manómetro intrínseco de cualquier monitor clínico.

Protocolo recomendado: Presión arterial invasiva
La medición directa e invasiva de la presión arterial proporciona una indicación gráfica y numérica en tiempo real de la presión, lo cual es esencial para el monitoreo intensivo, comúnmente en pacientes críticamente enfermos y en pacientes sometidos a procedimientos quirúrgicos extensos. Se coloca un catéter de tamaño pequeño en una arteria, preferiblemente la radial, justo proximal a la muñeca. El catéter se conecta a un transductor tipo galga extensiométrica que es el elemento variable de un puente de Wheatstone. Los fabricantes han elegido una variedad de señales para excitar el puente, que pueden ser tan bajas como 2 V o tan altas como 16 V, y a frecuencias desde corriente continua (DC) hasta varios miles de Hz. La impedancia típica ofrecida por el sensor es de 300 Ω. A lo largo de los años, se han utilizado dos sensibilidades diferentes, dependiendo de la marca: 5 µV o 40 µV por cada voltio de excitación, por mmHg de presión. 5 µV/Ve/mmHg es el más común, pero su simulador debería poder adaptarse a cualquiera de las sensibilidades, así como al rango completo de voltajes y frecuencias de excitación.
Después de conectar el cable adaptador correspondiente desde la UUT al simulador, lo mejor es verificar primero los valores de presión estática. Ingrese a la pantalla adecuada en el simulador y luego ajuste el canal de presión a cero en la UUT. Establezca una presión objetivo baja en el simulador y verifique que la UUT la muestre dentro de las tolerancias del monitor; luego establezca un valor clínicamente alto y repita la verificación.
La mayoría de los simuladores ofrecen opciones de ubicación anatómica del catéter, como la arteria radial, ventrículo izquierdo, arteria pulmonar, etc., que tienen características diferentes. Seleccione el sitio y luego elija un valor preestablecido para la presión arterial dinámica. Elija al menos dos preajustes y verifique que la UUT responda con gráficos y números dentro de las especificaciones. Si se puede agregar artefacto respiratorio a la simulación, repita uno de los preajustes más bajos con esa interferencia y verifique que el monitor supere el desafío.
También deberían estar disponibles señales de presión predefinidas para simular sitios arteriales centrales, como la presión arterial pulmonar o la presión “de cuña”, proporcionada por un catéter tipo Swan-Ganz. Para probar la UUT, así como para fines de entrenamiento, algunos simuladores proporcionan una secuencia de señales de onda con sincronizaciones típicas para procedimientos clínicos como la colocación de un catéter Swan-Ganz o para cateterización cardíaca.
Protocolo recomendado: Saturación de oxígeno La determinación no invasiva y beat-to-beat de la saturación de oxígeno en la sangre arterial ha sido una de las adiciones más importantes al monitoreo clínico y ha tenido un gran impacto en el cuidado de pacientes en situaciones de emergencia, sometidos a cirugía y en el cuidado ambulatorio de rutina. Se transmiten dos (o más) longitudes de onda de luz infrarroja (IR) a tejido bien perfundido (generalmente la parte distal de un dedo), donde la hemoglobina portadora de oxígeno absorbe una señal IR y la hemoglobina no oxigenada absorbe una longitud de onda IR diferente. Se detectan y comparan las dos señales de IR, lo que resulta en un porcentaje derivado de hemoglobina oxigenada expresado como SpO2. La saturación ideal es del 100%; las saturaciones hasta el 90% son típicas y las saturaciones inferiores al 90% son clínicamente significativas y generalmente requieren algún tipo de intervención.
No todos los sensores de oxímetro de pulso responden de manera idéntica a los diferentes niveles de saturación. En un mismo nivel de saturación, la relación de las señales de IR para la hemoglobina oxigenada y no oxigenada puede variar según la marca. Cada marca de sensor tiene su propia “curva R”: un gráfico que relaciona las relaciones de IR con la saturación porcentual. El primer paso para configurar una prueba de SpO2 es conocer el fabricante del sensor SpO2 utilizado por la UUT (muchos están licenciados para el fabricante del monitor) y seleccionar esa marca en el probador funcional de SpO2. El probador funcional de SpO2 debe tener la curva R para la mayoría de los fabricantes en su software. Si la marca no es seleccionable, debería ser posible descargar los datos de la curva R al probador funcional de SpO2 a través de un puerto (consulte la documentación del propietario).
Además, la tecnología “Rainbow” de Masimo utiliza longitudes de onda adicionales de IR para detectar % de metahemoglobina, % de carboxihemoglobina y hemoglobina en g/dL. Un probador funcional de SpO2 completamente capaz permitirá pruebas de estos factores mediante el uso de un cable adaptador.
Una vez configurado el probador funcional de SpO2 para un sensor de un fabricante específico o una curva R específica, el objetivo principal es verificar la respuesta de la UUT probando varios puntos de saturación en el espectro de posibilidades clínicas: se recomienda probar con saturaciones del 100%, 90%, 85% y 50% (paciente en asistolia). Un buen probador funcional de SpO2 emulará saturaciones tan bajas como el 30%. También debería permitir al usuario probar la UUT con una variedad de desafíos de transmisión, como un dedo grueso y oscuro, un dedo delgado y claro o la mayor transmisibilidad del pie de un recién nacido. Aunque estas son variaciones en la absorción de luz, el índice de perfusión, que es la relación entre la señal pulsátil y la señal de fondo, también debería ser variable. El índice de perfusión muestra la diferencia entre un pulso fuerte y enérgico en la arteria de un paciente sano y los pulsos débiles y de bajo volumen típicos en pacientes con compromiso cardiovascular.
Finalmente, el canal de SpO2 de la UUT debe ser probado con varias interferencias típicas. La SpO2 puede verse afectada por niveles altos de luz ambiental (especialmente luz con un alto componente IR), por frecuencias de línea de alimentación y por ciclos respiratorios.
Puede llevar mucho tiempo probar un monitor de SpO2 con todas las combinaciones de estas variables, pero un probador funcional de SpO2 minimiza ese problema mediante el uso de combinaciones predefinidas de parámetros clínicos que emulan a un paciente “normal” típico y varios escenarios de estados de enfermedad, como hipertensión, taquicardia, ataque cardíaco, etc. Estos ajustes predefinidos permiten al técnico probar todos los parámetros de un monitor simultáneamente en combinaciones realistas, incluso si no llegan a los extremos de cada parámetro.

Protocolo recomendado: Gasto cardíaco (GC)
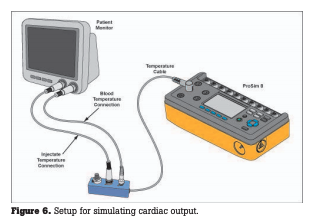
Aunque existen métodos alternativos para determinar el gasto cardíaco, la técnica de dilución térmica es el método de elección en la práctica clínica, principalmente durante la cirugía cardíaca. La técnica mide el cambio de temperatura en la sangre de una arteria principal cuando se inyecta un volumen conocido de un líquido. La temperatura del líquido inyectado puede ser temperatura ambiente (24 °C) o “helado” (cero °C). Dada la temperatura de la sangre (Ts), la temperatura del líquido inyectado (Ti), el volumen del líquido inyectado (Vi) y una constante de calibración específica del catéter utilizado, el gasto cardíaco en L/min se derivará del área bajo la curva tiempo-temperatura. La mayoría de los monitores muestran la curva junto con el valor numérico del GC como un medio para verificar visualmente que el GC se ha derivado de una forma de onda ideal y no distorsionada. (Inyectar de manera suave y rápida es esencial para una medición precisa).
La mayoría de los simuladores de GC utilizarán un adaptador para conectarse a la UUT, específico del fabricante del catéter. La serie de catéteres de Baxter (Edwards) se utiliza ampliamente. El usuario deberá ingresar la constante de calibración específica del catéter, que depende de la temperatura del líquido inyectado. Luego, el usuario ingresará la temperatura del líquido inyectado, ya sea helado (0 °C) o temperatura ambiente (24 °C). Un simulador de función completa también ofrecerá opciones para temperaturas de sangre ligeramente superiores o inferiores a los 37 °C estándar.
Después de configurar las variables en el simulador, comience una determinación de GC en la UUT, al mismo tiempo que comienza una curva de salida en el simulador. La UUT completará su determinación de GC y mostrará la curva y los valores numéricos asociados, los cuales deben coincidir con el valor preestablecido del simulador dentro de las tolerancias de las especificaciones de la UUT. Además de la precisión, verifique la repetibilidad: se deben realizar al menos tres determinaciones y sus valores deben ser casi idénticos, dentro de ± 0,1 L/min.
Un simulador de función completa también incluirá la opción de un “líquido inyectado defectuoso” simulado, es decir, una curva de temperatura distorsionada por una inyección interrumpida, o una curva de temperatura simulada en un paciente con un conducto entre los ventrículos izquierdo y derecho. Ambos casos son útiles para desafiar a la UUT a detectar y mostrar anomalías.
Protocolo recomendado: Temperatura
La mayoría de los monitores utilizan uno de los dos estándares de termometría médica basados en termistores establecidos por Yellow Springs Instruments en la década de 1950: la serie 400 utiliza un termistor de coeficiente negativo con una resistencia de 2252 Ω a 25 °C, y la serie 700 utiliza dos termistores para una mayor linealidad: 30 KΩ y 6 KΩ a 25 °C.
Conecte el adaptador adecuado desde la UUT (Unidad bajo prueba) al simulador y configure los puntos de alarma de temperatura en la UUT para valores clínicamente bajos y altos, por ejemplo, 36 °C y 40 °C. Configure el simulador para dos temperaturas en los extremos de las posibilidades clínicas; sugerimos 35 °C y 42 °C. Verifique que la UUT muestre valores dentro de las tolerancias especificadas por el fabricante y también verifique que estas temperaturas activen los umbrales de alarma en la UUT.
Protocolo recomendado: Respiración
Muchos monitores obtienen una forma de onda y una frecuencia respiratoria al aprovechar los electrodos de ECG en la parte superior del cuerpo. Con cada ciclo respiratorio, la impedancia entre los electrodos cambia ligeramente, lo que se puede utilizar para detectar la inspiración y la exhalación. En la mayoría de los casos, se aplica una pequeña señal a dos de los electrodos, y su amplitud se detecta, filtra y amplifica para mostrarla en el monitor. La frecuencia se obtiene a partir de los picos de la onda.
Suponiendo que el simulador ya esté conectado para ECG, no se necesita ningún adaptador. La impedancia de línea de base se puede ajustar: los valores típicos son de 500 Ω a 2000 Ω. El simulador debe configurarse para al menos dos extremos de frecuencia respiratoria, como 6 brpm (respiraciones por minuto) y 120 brpm, y los límites de alarma en la UUT deben configurarse para verificar su función.
Un simulador de función completa también permitirá al usuario variar la relación entre el tiempo inspiratorio y el tiempo espiratorio (I:E) desde 1:1 hasta 1:5, lo que puede ser útil para desafiar la precisión de la UUT cuando se utiliza en un paciente con ventilación mecánica. El simulador también puede ofrecer la opción de presentar la forma de onda respiratoria de un paciente ventilado, en la que la forma de onda varía debido a los cambios de impedancia en cada ciclo respiratorio.
Finalmente, si está disponible en el simulador, se debe verificar la alarma de apnea de la UUT configurando el simulador para crear una forma de onda plana acompañada de un temporizador para confirmar exactamente cuánto tiempo tarda la alarma de la UUT en activarse.
Referencias
American Society for Healthcare Engineering 1996, Apéndice 1: Clasificación de riesgo de equipos clínicos
24×7 Magazine, agosto de 2010, Diiulio, R: Artículo “The PM Debate”, páginas 32-34
The Joint Commission, Chicago, 2010: Manual de Acreditación Integral 2010 para Hospitales
Biomed Inst & Tech, noviembre-diciembre de 2009; 43(6), Ridgway, M: Artículo “Manufacturer recommended PM intervals: is it time for a change?”, páginas 498-500
A Practicum for Biomedical Engineering & Technology Management, Atles, LR, Kendall/Hunt, 2008, Wang, B: Evidence-based Medical Equipment Maintenance Management Organización
Internacional de Metrología Legal: # R-16-2: Esfigmomanómetros automatizados no invasivos R-90: Electrocardiógrafos: Características metrológicas: Métodos y equipos de verificación
Asociación para el Avance de la Instrumentación Médica: ANSI/AAMI EC13:2002/rev 2007: Monitores cardíacos, medidores de frecuencia cardíaca y alarmas
Asociación para el Avance de la Instrumentación Médica: ANSI/AAMI SP10:2002/A1:2003 rev 2008/ A2:rev 2006 rev 2008: Esfigmomanómetros electrónicos o automatizados
Agencias de acreditación hospitalaria seleccionadas:
Internacional: Organización Mundial de la Salud (OMS) Comisión Conjunta Internacional (JCI)
Europa: Federación Europea de Hospitales y Asistencia Sanitaria (HOPE) Hauté Autorité de Santé (HAS)
Reino Unido, Hong Kong, Filipinas: Acreditación Trent QHA (QHA)
Canadá: Acreditación Canadá
Australia: Estándares de Salud de Australia Internacional (ACHSI)
Nueva Zelanda: Calidad de Salud de Nueva Zelanda (QHNZ)
India: Junta Nacional de Acreditación de Hospitales (NABH)
Si deseas hablar con uno de nuestros agentes comerciales, llena el formulario para obtener más información. Gracias por todo lo que haces para mantener nuestro mundo en marcha.
¿Te gusto este artículo? Te invitamos a leer mas de nuestro contenido especializado en Metrología.
Cómo la Automatización de Flujos de Trabajo Apoya los Objetivos del Programa de Aseguramiento de Calidad de Dispositivos Médicos: Perspectiva de un Gerente
Gestionar un programa de aseguramiento de calidad de dispositivos médicos rentable puede ser...
Pruebas de Electrocirugía de Próximo Nivel
Únete a Fluke Biomedical con nuestras conexiones simples, seguras y eficientes para las pruebas de...
El software TruAsset CMMS se comunica con Fluke Biomedical OneQA
El software TruAsset CMMS está en constante evolución para satisfacer las cambiantes necesidades...
Habla con uno de nuestros agentes comerciales especialistas en Metrología Biomédica
Ingresa la información básica y nos estaremos comunicando contigo lo mas pronto posible.







